
Die aCRL®.academy Europe bietet BewusstSeinsBildung mit aCRL®.Farben und Formen im persönlichen und beruflichen Kontext an. Die aktuellen aCRL®.Farben und Formen wurden in einem Optimierungsprozess entwickelt und unterliegen ständiger Qualitätskontrolle. (siehe Fig. F1)
F&E-Projekte werden parallel durchgeführt, zur ständigen Überprüfung der aCRL® Methoden und Werkzeuge sowie bei neuen Anwendungen. Aktuell stehen folgenden Themen im Mittelpunkt:

Prof. Dr.-Ing.
Physik, Optik
Leitung der Forschung

M.Ed. Physik & Mathematik
aCRL® Entwicklung & Lehre

Fig. F1: Messplätze zur Farbcharakterisierung und Qualitätskontrolle und typische Messbeispiele
Die aCRL®.Farben und Grau-Formen unterliegen einer kontinuierlichen Qualitätskontrolle. Dabei werden ein kommerzielles Farbmess-Gerät oder ein faseroptischer Farbmess-Prototyp zur Analyse und Dokumentation eingesetzt. Die Farbwerte und die daraus abgeleiteten Abstände werden zu einem aCRL®.Standard gemessen.
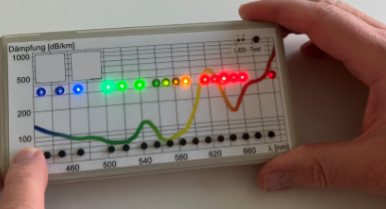
Fig. F2: Darstellung der möglichen Mittenwellenlängen typischer lichtemittierender Dioden (LEDs) in Abhängigkeit der Wellenlänge im sichtbaren Wellenlängenbereich sowie der Dämpfungskurve einer Polymerfaser, Stand 2010 /1/
In der physiologischen Forschung von Geweben und Zellen /2/ sind Ca2+, NADH, FAD, ATPase-Aktivität oder Membranpotential sowie deren zeitliche Änderungen bei Dehnung mittels Fluoreszenzdetektion /3/ durch eine faseroptische UV-Sonde detektierbar. (siehe Bild F3 und F4). Umgekehrt kann mit diesem System die Wirkung hinsichtlich Kraft bei unterschiedlichen aCRL®.Primär- und Sekundärfarben direkt untersucht werden.

Fig. F3: Anordnung zur Fluoreszenzmessung von Gewebe, dass durch Mikromanipulatoren kontrolliert mit Nano-Kräften bewegt wird /3/

Fig. F4: Faseroptischer Prototyp mit einer speziellen Anordnung von Lichtleitfasern zur kontrollierten Lichtdetektion /3/
/1/ LED-Prototyp für die Lehre im Bereich „Faseroptik“, realisiert vom POFAC an der TH Nürnberg
/2/ M. Brandenburger, J. Wenzel, R. Bogdan, D. Richardt, F. Nguemo, M. Reppel, J. Hescheler, H. Terlau, A. Dendorfer, “Organotypic slice culture from human adult ventricular myocardium”, Cardiovasc Res. 93(1), 50-9 (2012).
/3/ M. Belz, A. Dendorfer, J. Werner, D. Lambertz, K.-F. Klein: “Fiber Optic Biofluorometer for Physiological Research on Muscle Slices”; Proc. of SPIE Vol. 9702, 97020Q (San Francisco, Jan. 2016)